Mudanças de fase ou estados de agregação
x
Tipos de VaporizaçãoEvaporação: processo espontâneo e lento que ocorre na superfície do líquido.
Ebulição: processo no qual há formação tumultuosa de bolhas, ocorrendo em toda massa líquida. A ebulição se verifica a uma determinada temperatura (temperatura de ebulição) que depende da pressão exercida sobre a superfície do líquido. Por exemplo, a água entra em ebulição a 100 ºC sob pressão normal (1 atmosfera).
Lei da mudança de fase
Sob pressão constante, durante a mudança de fase a temperatura permanece constante.
Calor latente (L)
Numericamente é a quantidade de calor que a substância troca (ganha ou perde), por unidade de massa, durante a mudança de estado, mantendo-se constante a temperatura.
Unidade: cal/g
Quantidade de calor trocada durante a mudança de estado por uma massa m de uma substância.
Q = m.L
Curva de aquecimento da água
A: aquecimento do gelo
B: fusão do gelo a 0 ºC
C: aquecimento da água líquida
D: vaporização da água líquida a 100 ºC
E: aquecimento do vapor
Calor latente de fusão do gelo (Lf) e de vaporização da água (Lv)
Exercícios básicos
Exercício 1:
No interior de uma cavidade existente num grande bloco de gelo, à temperatura de
0 °C, é colocada uma pequena esfera de ferro de massa 100 g à temperatura de
40 °C. Desprezadas as perdas de calor para o ambiente, determine a quantidade de água que se forma na cavidade quando se estabelece o equilíbrio térmico. O calor específico do ferro é 0,113 cal/g.ºC e o calor latente de fusão do gelo é 80 cal/g.
Exercício 2:
Uma esfera de cobre de massa 270 g e à temperatura de 200 ºC é colocada num recipiente contendo água em ebulição a 100 ºC. Atingido o equilíbrio térmico, observa-se que ainda existe água no recipiente. Qual é a massa de água que vaporizou?
Dados:
calor específico do cobre 0,094 cal/g.ºC
calor latente de vaporização da água 540 cal/g.
x
Exercício 3:
Quantos bloquinhos de gelo, cada um de massa 10 g à temperatura
de 0 ºC, devem ser colocados em 240 g de água a 60 ºC, para que a temperatura final de equilíbrio, desprezadas as perdas, seja de 40 ºC?
Dados:
calor específico da água 1,0 cal/g.ºC
calor latente de fusão do gelo 80 cal/g.
Exercício 4:
Qual é a quantidade de calor necessária para transformar 50 g de gelo a -20 ºC em vapor de água a 110 ºC?
São dados:
calor específico do gelo: 0,50 cal/g.ºC
calor específico da água: 1,0 cal/g.ºC
calor específico do vapor de água: 0,45 cal/g.ºC
calor latente de fusão do gelo: 80 cal/g
calor latente de vaporização da água: 540 cal/g
Faça, a seguir, o gráfico da temperatura θ em função da quantidade de calor Q,
representando todas as etapas do processo (curva de aquecimento).
Exercício 5:
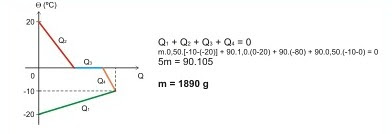
Num calorímetro de capacidade térmica desprezível são misturados uma massa m de gelo a -20 ºC com 90 g de água a 20 ºC. Determine, em cada caso abaixo, o valor de m para que no equilíbrio térmico tenha somente:
a) água a 0 ºC
b) gelo a 0 ºC
c) água a 10 ºC
d) gelo a -10 ºC
Dados:
calor específico do gelo: 0,50 cal/g.ºC
calor específico da água: 1,0 cal/g.ºC
calor latente de fusão do gelo: 80 cal/g
calor latente de solidificação da água: -80 cal/g
Despreze as perdas de calor para o meio exterior.
Exercício 1: resolução
Qfusão + Qferro = 0 => m.Lf + (m.c.Δθ)ferro = 0 =>
m.80 + 100.0,113.(0-40) = 0 => m = 5,65 g
Resposta: 5,65 g
Exercício 2: resolução
Como existe água no recipiente e somente parte vaporizou, concluímos que a temperatura de equilíbrio térmico é 100 ºC.
Qcobre + Qvaporização = 0 => m.c.Δθ + m.Lv = 0 =>
270.0.94.(100-200) + m.540 = 0 => m = 4,7 g
Resposta: 4,7 g
Exercício 3: resolução
Qfusão + Qágua1 + Qágua2 = 0 =>
N.10.80 + N.10.(40-0) + 240.2,0.(40-60) = 0 => N = 4
Resposta: 4 bloquinhos
Exercício 4: resolução
x
Q = Qgelo + Qfusão + Qágua + Qvaporização + Qvapor
Q = (m.c.Δθ)gelo +m.Lf + (m.c.Δθ)água + m.Lv + (m.c.Δθ)vapor
Q = 50.0,50.[0-(-20)] + 50.80 + 50.1,0.(100-0) + 50.540 + 50.0,45.(110-100)
Q = 500 + 4000 + 5000 + 27000 + 225
Q = 36725 cal
Respostas:
Q = 36725 cal
Gráfico acima
Exercício 5: resolução
a)
b)
c)
d)
Respostas:
a) 20 g
b) 900 g
c) 9 g
d) 1890 g







Nenhum comentário:
Postar um comentário