Parte 2
Q: A segunda lei e A lei de Murphy** - elas estão relacionadas?
R: Sim, mas eu não deveria ter mencionado isso. Primeiro, precisamos saber um pouco mais sobre problemas que podem acontecer para nós por causa do comportamento de produtos químicos no objetos ao nosso redor. Para um exemplo triste, queimar casas em madeira, com perda financeira desastrosa, mesmo quando as pessoas não são mortas. O que está acontecendo aqui em termos de fluxo energético?
OBS IMPORTANTE: A Lei de Murphy não é científica. É apenas uma brincadeira para demonstrar como as coisas parecem acontecer todas de forma desastrosa. Postagem de amanhã
Q: A segunda lei e A lei de Murphy** - elas estão relacionadas?
R: Sim, mas eu não deveria ter mencionado isso. Primeiro, precisamos saber um pouco mais sobre problemas que podem acontecer para nós por causa do comportamento de produtos químicos no objetos ao nosso redor. Para um exemplo triste, queimar casas em madeira, com perda financeira desastrosa, mesmo quando as pessoas não são mortas. O que está acontecendo aqui em termos de fluxo energético?
OBS IMPORTANTE: A Lei de Murphy não é científica. É apenas uma brincadeira para demonstrar como as coisas parecem acontecer todas de forma desastrosa. Postagem de amanhã
Madeira e papel são ambos principalmente celulose. Papel é mais fácil de entender, então vamos refletir sobre a sua queima no ar. Quando papel se incendeia, há uma grande quantidade de energia cedida como calor e luz amarela. É conhecido que os produtos da combustão de celulose com o oxigênio (do ar), são o dióxido de carbono e água. (A pequena quantidade de preto nas cinzas é devido aos minerais que estavam no papel e que absorvem uma pequena quantidade de carbono). Uma vez iniciada, a combustão é espontânea - ou seja, o processo ocorre por si mesmo, sem qualquer ajuda adicional - e também a queima é muito rápida. Agora, se toda a energia que está fluindo na presente reação de papel com oxigênio, o papel e o oxigênio deve ter tido muito mais energia dentro deles antes da reação do que o dióxido de carbono e água após a reação - como mostrado no diagrama abaixo.
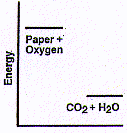
O que está acontecendo aqui é uma bela ilustração das previsões da Segunda Lei. Sistemas (grupos) de produtos químicos - ou objetos fabricados a partir deles (como folhas de papel ou casas) - tendem a reagir no caso de terem mais energia vinculada dentro de suas moléculas do que os produtos de reação que possam formar. [[Nota para estudantes avançados: "aqui significa mudança energia
Essas moléculas mais rápidas mostram uma alta temperatura em um termômetro. Dizemos elas estão quentes, e não porque o calor é uma "coisa", mas porque o calor é o processo de transferência de energia a partir de um tipo de matéria para outro - a partir de moléculas de gás rápido para um bulbo de termômetro ou para as mãos de alguém que se aproximar da chama produzida pela queima.
Q: Espere um minuto! Espere um minuto! Você teve que riscar um fósforo, para que o papel de começar a queimar-lo! O que tem de espontâneo ou de Segunda Lei nisso?
R: Espere um minuto você! Já se esqueceu que a palavra essencial "tende" na Segunda Lei?
Todo o papel e madeira e as coisas feitas a partir das mesmas em todo o mundo tendem agora mesmo a reagir com o oxigênio do ar e formar uma gigantesca bola de fogo. Porque não o fazem? Pois bem, por que nem todas as montanhas na terra espalham o seu elevado potencial energético presentes nas pedras e formam amontoados de areia? É a força das ligações químicas (entre silício, oxigênio, potássio, alumínio e outros átomos e íons) que segura as partes das pedras unidas e que impede a imediata ação da Segunda Lei da termodinâmica. O elevada energia potencial das rochas em local alto/montanhas é impedida de se espalhar instantaneamente.
Então é assim, a força das ligações químicas (entre carbono, hidrogênio e oxigênio) na celulose mantêm o sistema coeso e obstruem a propagação instantâneas da energia para fora do sistema pela reação com o oxigênio do ar. Esta força de ligação evita que o oxigênio quebre as ligações entre as moléculas de celulose para formar lugações fortes (de dióxido de carbono e água) e assim liberar grander quantidade de energia. Contudo é necessário apenas um pequeno empurrão da energia de um fósforo aceso para se iniciar a quebra de alguns quatrilhões de ligações na celulose do papel ou madeira reagindo com o oxigênio para formar vários quatrilhões de moléculas de CO2 e H2O.
O empurrão inicial (usualmente provindo do calor), mostrado pelo pequeno ´morro´ de energia no diagrama abaixo, é conhecido como energia de ativação, Ea, e esta é necessária para romper a barreira da força de ligação que é obstáculo para a Segunda Lei nas reações químicas. Portanto, esta necessidade de um impulso inicial de energia, a energia de ativação, impede reações desejáveis e indesejáveis de ocorrerem.
Uma idéia importante é "A energia de ativação ´protege´ as susbtâncias da mudança. "
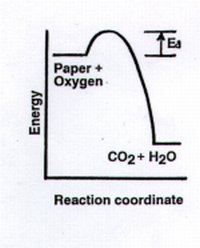
Quando essas primeiras ligações "aquecidas" estão se quebrando, o oxigênio do ar começa a capturar átomos de carbono e hidrogênio para formar moléculas de dióxido de carbono e água. Mas a formação de novas ligações fortes no CO2 e água resultam em bastante energia -- o suficiente para ajudar na quebra de ainda mais ligações na celulose. Essas novas moléculas de CO2 e água também absorvem alguma quantidade de energia aumentando a velocidade de movimento; nós sentimos esse aumento como se estivessem mais quentes.
Q: Aha. Eu lembro que nos incêndios florestais de Malibu (EUA) a alguns anos algumas casas começaram a se incendiar de dentro para fora por causa do calor causado pela queima de árvores nas proximidades, o calor incendiou os tecidos em salas com janelas transparentes. Em outros casos o incêndio foi evitado pois as janelas tinham cobertura metálica e estavam fechadas. Isso envolve energia de ativação, certo? Roupas de cama contém celulose, correto?R: Sim para ambas perguntas. Em primeiro lugar, o vidro das janelas ficou extremamente quente, por causa tanto do ar aquecido como da radiação infravermelha emitida pelo fogo. Em conjunto, como você sugere, a intensa radiação infravermelha passou pelas janelas transparentes e aqueceu os tecidos no interior da casa -- o que foi suficiente para exceder a energia de ativação que impedia os tecidos de sofrerem oxidação com o oxigênio do ar. Os tecidos começaram a queimar dando ainda mais energia para queimar todo o ambiente -- excedendo todas energias de ativação necessárias para oxidação de quase todos materiais na casa.
Tal como cada idéia da qual falamos neste texto, o conceito de energia de ativação nos dá uma excelente poder de entendimento de como o mundo funciona, mesmo em eventos pouco usuais. Em algum momento você já deve ter ouvido falar dos perigos da nitroglicerina, um líquido que explode violentamente se agitado ou manuseado sem cuidado. Você acha que o diagrama de energias neste caso seria o mesmo da celulose? É claro que não. No caso da nitroglicerina a energia de ativação deve ser muito menor. Existe uma tendência muito forte para a formação de produtos gasosos muito quentes gerando uma explosão (apesar da pequena diferença de energia entre a nitroglicerina e os produtos). Explosivos formam gases quentes tão rapidamente porque eles têm átomos de oxigênio como parte de suas moléculas. Portanto, estas moléculas não precisam esperar até que algumas moléculas de oxigênio atmosférico entrem em contato com as do explosivo -- como ocorrem em reações normais com oxigênio. Alfred Nobel estava tentando inventar um explosivo mais seguro quando quatro trabalhadores e seu irmão foram mortos na fábrica de nitroglicerina da família. Ele fez o que chamou de ´dinamite´ quando misturou nitroglicerina com alguma sílica em pó para formar um sólido seco mais seguro que poderia ser manufaturado em forma de bastões. Esses bastões não detonam se deixados cair ou atingidos com algo. Obviamente, portanto, o diagrama de energia de uma dinamite é mais semelhante ao caminho representado pela linha pontilhada, com energia de ativação mais elevada, esta energia deve ser fornecida então, por um detonador que iniciará a detonação espontânea da nitroglicerina. (TNT, usado em bombas, é seis vezes mais resistente ao choque do que a nitroglicerina. Portanto você pode adivinhar como é a energia de ativação neste caso). Atualmente a dinamite já foi trocada por outros tipos de explosivos para uso em escavações.
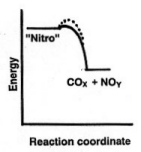
Aqui nos comentamos sobre algumas substâncias com baixas energia de ativaçõa, mas no dia-a-dia não lidamos com nitro ou TNT! Que tal abordar um tema mais cotidiano como o ferro que se oxida (enferruja, como resultado da reação de ferro com oxigênio). É claro, estamos correndo o risco de abrir uma caixa de surpresas de toda relação das atividades humanas e a Segunda Lei.

Nenhum comentário:
Postar um comentário